大学职业资格刷题搜题APP

创建自己的小题库
搜索

焓变、反应热题库
题数
1264
考试分类
高中化学>焓变、反应热
售价
¥30
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-焓变、反应热
...更多


章节目录
题目预览(可预览10题)
【简答题】

[1/1264]为解决能源危机,在汽油中掺入一定比例的乙醇(即“乙醇汽油”),以代替一部分汽油.乙醇在气缸中完全燃烧的热化学方程式为:12C2H5OH(l)+32O2...
参考答案:
| A、反应过程中断裂化学键吸收热量;故A错误; B、反应是放热反应,反应物总能量大于生成物总能量;故B错误; C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;热化学方程式中可燃物不是1mol,故C错误; D、反应从液态水生成气态水时,需要吸收能量,反应焓变大于-683.4kJ/mol;故D正确; 故选D. |
参考解析:
无
【简答题】

[2/1264]下列说法中错误的是( ) A.物质燃烧可看成“储存”在物质内部的能量转化为热能、光能等形式释放出来B.绿色植物进行光合作用时,将太阳能转化为化学能“...
参考答案:
| A.物质燃烧是放热反应,可看成“储存”在物质内部的能量转化为热能、光能等形式释放出来,故A正确; B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来,故B正确; C.当反应物的能量低于生成物总能量时,反应是吸热反应;当反应物的能量高于生成物总能量时,反应是放热反应,所以生成物总能量不一定低于反应物总能量,故C错误; D.破坏旧化学键吸收的能量大于形成新化学键释放的能量时,则该反应是吸热反应,故D正确; 故选:C; |
参考解析:
无
【简答题】

[3/1264]已知:H 2(g)+ 【图片】O 2(g)=H 2O(1) △H=-285.8kJ·mol -1 &nbs...
参考答案:
|
D
|
参考解析:
略
【简答题】

[4/1264]在常温常压下,已知:4Fe(s) + 3O 2(g) = 2Fe 2O 3(s) ΔH 14Al(s) ...
参考答案:
|
D
|
参考解析:
略
【简答题】

[5/1264]根据热化学方程式:S(s) + O 2(g)= SO 2(g);△H=akJ·mol -1(a=-297.2),分析下列说法中不正确的是 A.S(s)...
参考答案:
|
B
|
参考解析:
硫燃烧是放热反应,说明反应物的总能量高于生成物的总能量,所以A、C正确。根据热化学方程式可知计算,选项D正确。由于气态硫的能量高于固态硫的能量,所以气态硫燃烧放出的热量多余固态硫燃烧放出的能量,但放热越多,△H越小,所以a大于b,选项B不正确,答案选B。
【简答题】

[6/1264]甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H 2 ( g ) 【图片】CH 3OH ( g ) △H =-90.8 ...
参考答案:
|
(1)K=C(CH
3OH)/C
2(H
2)•C(CO) (2)4 (3)A C D (4) A
(5)CO 2(g) +3H 2(g)  CH
3OH(g) +H
2O(g) △H=-49.5 kJ·mol
-1 CH
3OH(g) +H
2O(g) △H=-49.5 kJ·mol
-1
|
参考解析:
(1)根据平衡常数的定义可得到该反应的化学平衡常数的表达式为K==C(CH 3OH)/C 2(H 2)•C(CO)。(2)若密闭容器中充入10 mol CO 和20 molH 2,当达到平衡状态A 时,CO的转化率为0.5,此时各物质的物质的量为CO为5mol;H 2为10mol; CH 3OH为5mol。n(气体)=20mol,容器的体积为20 L。如反应开始时仍充入10mol CO 和20mol H 2,在达到平衡状态B时CO的转化率为0.8,则此时各物质的物质的量为CO为2mol,H 2为4mol, CH 3OH为8mol。n(气体)=14mol。由于A、B是在相同温度下程度的。所以化学平衡常数不变设第二次达到平衡时容器的体积为V。则
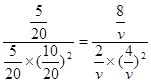 ,解得v=4(L)。(3) A.CO的含量保持不变,则各组分的物质的量,总物质的量不变。可逆反应达到平衡状态。正确。B.容器中CH
3OH浓度与CO浓度相等,这只是一个很特殊的情况,这时反应可能达到平衡,也可能未达到平衡状态。错误。C.在任何时刻2V
正(CH
3OH)=V
正(H
2),若2V
正(CH
3OH)=V
逆(H
2),则V
正(H
2)=V
逆(H
2),反应达到平衡。正确。D.由于该反应是个反应前后气体体积不等的反应,如果反应未达到平衡,则气体的物质的量就会发生改变,混合气体的平均相对分子质量也就会随着改变。若容器中混合气体的平均相对分子质量保持不变,则气体的物质的量不变。故反应达到平衡状态。正确。(4)A.由于该反应的正反应是放热反应,所以在其它条件不变的情况下,升高温度,平衡向吸热反应方向移动,也就是向逆反应方向移动,这时反应物的转化率降低。因为CO的平衡转化率a>b>c,所以温度:T
1 < T
2 <T
3。正确。B.在其它条件不变时,升高温度,化学反应速率加快。由于温度T
1 < T
2 <T
3,所以速率:ν(c)>ν(a);在其它条件相同时,增大压强,化学反应速率加快。由于压强b>d,所以速率:ν(b)>ν(d).错误。C.化学 平衡常数只与温度有关,与其它条件无关。由于温度T
1 < T
2 <T
3。升高温度,平衡向逆反应方向移动,K减小。K(a) >K(c) ; K(b) =K(d)。错误。D.升高温度,平衡向逆反应方向移动,平衡时气体的物质的量增大,气体的平均摩尔质量减小。由于温度T
1 < T
3,所以平衡时n(c)总> n(a)总,M(a)>M(c);在相同的温度下,增大压强,平衡正向移动,平衡时气体的物质的量减小。所以平衡时n(d)总> n(b)总,M(b)>M(d).错误。(5)将CO
2(g)+H
2(g)
,解得v=4(L)。(3) A.CO的含量保持不变,则各组分的物质的量,总物质的量不变。可逆反应达到平衡状态。正确。B.容器中CH
3OH浓度与CO浓度相等,这只是一个很特殊的情况,这时反应可能达到平衡,也可能未达到平衡状态。错误。C.在任何时刻2V
正(CH
3OH)=V
正(H
2),若2V
正(CH
3OH)=V
逆(H
2),则V
正(H
2)=V
逆(H
2),反应达到平衡。正确。D.由于该反应是个反应前后气体体积不等的反应,如果反应未达到平衡,则气体的物质的量就会发生改变,混合气体的平均相对分子质量也就会随着改变。若容器中混合气体的平均相对分子质量保持不变,则气体的物质的量不变。故反应达到平衡状态。正确。(4)A.由于该反应的正反应是放热反应,所以在其它条件不变的情况下,升高温度,平衡向吸热反应方向移动,也就是向逆反应方向移动,这时反应物的转化率降低。因为CO的平衡转化率a>b>c,所以温度:T
1 < T
2 <T
3。正确。B.在其它条件不变时,升高温度,化学反应速率加快。由于温度T
1 < T
2 <T
3,所以速率:ν(c)>ν(a);在其它条件相同时,增大压强,化学反应速率加快。由于压强b>d,所以速率:ν(b)>ν(d).错误。C.化学 平衡常数只与温度有关,与其它条件无关。由于温度T
1 < T
2 <T
3。升高温度,平衡向逆反应方向移动,K减小。K(a) >K(c) ; K(b) =K(d)。错误。D.升高温度,平衡向逆反应方向移动,平衡时气体的物质的量增大,气体的平均摩尔质量减小。由于温度T
1 < T
3,所以平衡时n(c)总> n(a)总,M(a)>M(c);在相同的温度下,增大压强,平衡正向移动,平衡时气体的物质的量减小。所以平衡时n(d)总> n(b)总,M(b)>M(d).错误。(5)将CO
2(g)+H
2(g)
 CO(g)+H
2O(g) △H=" +" 41.3 kJ/mol和 CO ( g ) + 2H
2 ( g )
CO(g)+H
2O(g) △H=" +" 41.3 kJ/mol和 CO ( g ) + 2H
2 ( g )
 CH
3OH ( g ) △H
=-90.8 kJ/mol相加可得CO
2和H
2制取甲醇的热化学方程式:CO
2(g) +3H
2(g)
CH
3OH ( g ) △H
=-90.8 kJ/mol相加可得CO
2和H
2制取甲醇的热化学方程式:CO
2(g) +3H
2(g)
 CH
3OH(g) +H
2O(g) △H=-49.5 kJ/mol.
CH
3OH(g) +H
2O(g) △H=-49.5 kJ/mol.
【简答题】

[7/1264]在1200℃时,天然气脱硫工艺中会发生下列反应 ①H 2S(g)+ 【图片】O 2(g)=SO 2(g)+H 2O(g) &nb...
参考答案:
|
A
|
参考解析:
根据盖斯定律,①×
 -③×
-③×
 得⑤:
得⑤:
 S(g)+
S(g)+
 O
2 (g)=
O
2 (g)=
 SO
2 (g) △H
5=
SO
2 (g) △H
5=
 (△H
1 -△H
3);根据盖斯定律,②×
(△H
1 -△H
3);根据盖斯定律,②×
 -③×
-③×
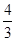 得⑥:
得⑥:
 SO
2 (g)+
SO
2 (g)+
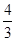 S(g)=
S(g)=
 O
2 (g) + S
2(g) △H
6=
O
2 (g) + S
2(g) △H
6=
 (△H
2 -2△H
3);⑤+⑥得:2S(g) =S
2(g) △H
4=
(△H
2 -2△H
3);⑤+⑥得:2S(g) =S
2(g) △H
4=
 (△H
1+△H
2-3△H
3),答案为A。
(△H
1+△H
2-3△H
3),答案为A。
【考点定位】热化学方程式、盖斯定律的应用
 -③×
-③×
 得⑤:
得⑤:
 S(g)+
S(g)+
 O
2 (g)=
O
2 (g)=
 SO
2 (g) △H
5=
SO
2 (g) △H
5=
 (△H
1 -△H
3);根据盖斯定律,②×
(△H
1 -△H
3);根据盖斯定律,②×
 -③×
-③×
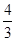 得⑥:
得⑥:
 SO
2 (g)+
SO
2 (g)+
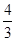 S(g)=
S(g)=
 O
2 (g) + S
2(g) △H
6=
O
2 (g) + S
2(g) △H
6=
 (△H
2 -2△H
3);⑤+⑥得:2S(g) =S
2(g) △H
4=
(△H
2 -2△H
3);⑤+⑥得:2S(g) =S
2(g) △H
4=
 (△H
1+△H
2-3△H
3),答案为A。
(△H
1+△H
2-3△H
3),答案为A。
【考点定位】热化学方程式、盖斯定律的应用
【简答题】

[8/1264]已知反应:H 2(g)+ 【图片】O 2(g)=H 2O(g) △H 1 【图片】N 2(g)+O 2(g)=NO 2(g)&n...
参考答案:
|
D
|
参考解析:
考查盖斯定律的应用。根据已知反应①H
2(g)+
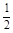 O
2(g)=H
2O(g)、②
O
2(g)=H
2O(g)、②
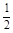 N
2(g)+O
2(g)=NO
2(g)、③
N
2(g)+O
2(g)=NO
2(g)、③
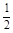 N
2(g)+
N
2(g)+
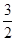 H
2(g)=NH
3(g)可知,将①×3+2×②-2×③即得到2NH
3(g)+
H
2(g)=NH
3(g)可知,将①×3+2×②-2×③即得到2NH
3(g)+
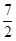 O
2(g)=2NO
2(g)+3H
2O(g),所以该反应的反应热为△H=3△H
1+2△H
2-2△H
3。所以正确的答案是D。
O
2(g)=2NO
2(g)+3H
2O(g),所以该反应的反应热为△H=3△H
1+2△H
2-2△H
3。所以正确的答案是D。
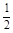 O
2(g)=H
2O(g)、②
O
2(g)=H
2O(g)、②
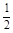 N
2(g)+O
2(g)=NO
2(g)、③
N
2(g)+O
2(g)=NO
2(g)、③
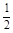 N
2(g)+
N
2(g)+
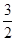 H
2(g)=NH
3(g)可知,将①×3+2×②-2×③即得到2NH
3(g)+
H
2(g)=NH
3(g)可知,将①×3+2×②-2×③即得到2NH
3(g)+
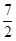 O
2(g)=2NO
2(g)+3H
2O(g),所以该反应的反应热为△H=3△H
1+2△H
2-2△H
3。所以正确的答案是D。
O
2(g)=2NO
2(g)+3H
2O(g),所以该反应的反应热为△H=3△H
1+2△H
2-2△H
3。所以正确的答案是D。
【简答题】

[9/1264]已知:(1)Zn(s)+1/2O 2(g)=ZnO(s) △H=-348.3kJ·mol -1 , (2)2Ag(s)+1/2...
参考答案:
|
A
|
参考解析:
由热化学方程式:(1)Zn(s)+1/2O
2(g)=ZnO(s) △H=-348.3kJ·mol
-
1
,(2)2Ag(s)+1/2O
2(g)=Ag
2O(s) △H=-31.0kJ·mol
-
1,可知,将两热化学方程式叠加,得Zn(s)+Ag
2O(s)=ZnO(s)+2Ag(s)△H=-317.3kJ·mol
-
1
【简答题】

[10/1264]25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是 A.2H2(g)+O2(g) ="=" 2...
参考答案:
|
D
|
参考解析:
2g氢气燃烧生成液态水,放出285.8kJ热量,即1mol氢气燃烧生成液态水,放出285.8kJ热量;所以
A错,热化学方程式中的化学计量数表示物质的量;B错,放热反应的反应为“—”;C错,生成水的状态为液态,不是气态;D正确;
A错,热化学方程式中的化学计量数表示物质的量;B错,放热反应的反应为“—”;C错,生成水的状态为液态,不是气态;D正确;

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫