大学职业资格刷题搜题APP

创建自己的小题库
搜索

离子反应题库
题数
726
考试分类
高中化学>离子反应
售价
¥25
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-离子反应
...更多


章节目录
题目预览(可预览10题)
【简答题】

[1/726]下列反应既是离子反应,又是氧化还原反应的是 [ ] A.BaCl2溶液中滴加稀H2SO4 B.盐酸和氧...
参考答案:
| C |
参考解析:
无
【简答题】

[2/726]根据下图装置,分别写出A、B、C装置中发生的现象和有关反应的离子方程式。 【图片】 (1)装置A中发生的现象是_________________; 此...
参考答案:
| (1)有气体产生,固体不断减少;CaCO3+2H+=Ca2++CO2↑+H2O (2)无明显现象 (3)溶液中产生浑浊;Ca2++2OH-+CO2=CaCO3↓+H2O |
参考解析:
无
【简答题】

[3/726]某10 mL溶液中可能含有OH -、CO 32-、AlO 2-、SiO 32-、SO 42-、Na +、K +、Fe 3+、Mg 2+、Al 3+等离...
参考答案:
|
C
|
参考解析:
根据题给图像知,开始向溶液中逐滴加人1 mol/L的盐酸无沉淀生成,说明加入的盐酸和溶液中的OH -反应,则溶液中存在大量氢氧根离子,与氢氧根离子反应的离子不能共存,溶液中一定没有Fe 3+、Mg 2+、Al 3+;随着盐酸加入量的增加,反应生成沉淀逐渐增大,然后不变,最后沉淀量逐渐减少但不消失,说明溶液中AlO 2 -、SiO 3 2-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO 3 2-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定是否存在,根据溶液的电中性原则可知,溶液中K +、Na +至少存在一种。A、根据上述分析知,原溶液中肯定含有的离子是:OH -、SiO 3 2-、AlO 2 -、CO 3 2-,K +、Na +至少存在一种,错误;B、溶液中硫酸根离子不能确定是否存在,无法计算溶液中阳离子的物质的量浓度,错误;C、根据题给图像分析,与碳酸根离子反应的盐酸为2体积,氢氧化铝溶解消耗的盐酸体积为4体积,结合反应CO 3 2-+2H +=CO 2↑+H 2O ,Al(OH) 3+3H +=Al 3++3H 2O分析,原溶液中含有CO 3 2-与AlO 2 -的物质的量之比为3:4,正确;D、溶液中氢氧根的物质的量无法确定,无法计算a值,错误。
【简答题】

[4/726]下列反应过程符合如图所示关系的是 【图片】A.向Ba(NO3)2溶液中通入SO2气体至过量B.向Na2SiO3溶液中通入HCl气体至过量C.向澄清石灰...
参考答案:
|
C
|
参考解析:
A、生成BaSO 4沉淀,错误;B、生成H 2SiO 3沉淀,错误;C、发生的反应为Ca(OH) 2+CO 2+H 2O=CaCO 3↓+H 2O,CaCO 3+CO 2+H 2O=Ca(HCO 3) 2由此可知生成沉淀和沉淀的溶解过程中消耗的CO 2的体积比为1:1,正确;D、反应为NaAlO 2+HCl+H 2O=Al(OH) 3↓+NaCl,Al(OH) 3+3HCl=AlCl 3+3H 2O由此可知生成沉淀和沉淀的溶解过程中消耗的HCl的体积比为3:1,错误。
【简答题】

[5/726]对于某酸性溶液(可能含有Br –、SO 42 –、H 2SO 3、NH 4+),分别进行如下实验: ①加热时放出的气体可使品红溶液褪色;②加入碱溶液使...
参考答案:
|
B
|
参考解析:
①某酸性溶液加热时放出的气体可使品红溶液褪色;证明含有H 2SO 3;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;证明含有NH 4 +;③加入氯水时,溶液略呈橙红色,证明含有Br –。由于氯水有强氧化性,会把H 2SO 3氧化为H 2SO 4.产生了SO 4 2 –;再加入BaCl 2溶液,产生不溶于稀硝酸的白色沉淀。证明该溶液中含SO 4 2 –,但是不一定是原来溶液中含有的。不能确定其在原溶液中是否存在的是SO 4 2–。选项是B。
【简答题】

[6/726]将足量稀盐酸加入下列固体混合物中,只能发生一个反应的是 A.Mg、AlCl3、NaAlO2B.KNO3、NaCl、CH3COONaC.NaClO、Na...
参考答案:
|
B
|
参考解析:
Mg + 2HCL === MgCL
2 + H
2;NaALO
2 + 4HCL ===ALCL
3 + NaCL + 2H
2O,A错;
CH 3COONa + HCL ===== CH 3COOH + NaCL,B正确;NaCLO + HCL ===== NaCL + HCLO,
Na 2SO 3 + 2HCL ===== 2NaCL + SO 2 + H 2O;NaCLO + Na 2SO 3===== Na 2SO 4 + 2NaCL,
HCLO + Na 2SO 3===== Na 2SO 4 + HCL;Na 2SO 4 + BaCL 2===== BaSO 4 + 2NaCL,C错;
HCL + NH 4HCO 3===== NH 4CL + CO 2 + H 2O,Ba(NO 3) 2、FeSO 4、HCL可以反应,其离子方程式为:Ba 2++ NO 3 - + 3Fe 2 + + 4H + +SO 4 2-===== BaSO 4 + 3Fe 3 + + NO + 2H 2O,D错。
CH 3COONa + HCL ===== CH 3COOH + NaCL,B正确;NaCLO + HCL ===== NaCL + HCLO,
Na 2SO 3 + 2HCL ===== 2NaCL + SO 2 + H 2O;NaCLO + Na 2SO 3===== Na 2SO 4 + 2NaCL,
HCLO + Na 2SO 3===== Na 2SO 4 + HCL;Na 2SO 4 + BaCL 2===== BaSO 4 + 2NaCL,C错;
HCL + NH 4HCO 3===== NH 4CL + CO 2 + H 2O,Ba(NO 3) 2、FeSO 4、HCL可以反应,其离子方程式为:Ba 2++ NO 3 - + 3Fe 2 + + 4H + +SO 4 2-===== BaSO 4 + 3Fe 3 + + NO + 2H 2O,D错。
【简答题】

[7/726]在含FeCl 3、FeCl 2、AlCl 3、NaCl的溶液中,加入足量的Na 2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化...
参考答案:
|
B
|
参考解析:
过氧化钠溶于水生成氢氧化钠和氧气,所以铁离子和亚铁离子都生成氢氧化铁沉淀。铝离子则生成偏铝酸钠。然后再加入足量盐酸,又生成氯化铁和氯化铝,因此离子数目变化最小的是铝离子,答案选B。
【简答题】

[8/726]下列四个反应可用H++OH -=H 2O这个离子方程式表示的是( ) A.Ba(OH)2溶液与稀硫酸 B.Cu(OH...
参考答案:
|
C
|
参考解析:
A不正确,因为反应中还有硫酸钡白色沉淀生成;B不正确,氢氧化铜是难溶性物质,应该用化学式表示;D不正确,氨水是弱碱,应该用化学式表示,因此正确的答案选C。
点评:该题是中等难度的试题,属于离子方程式的逆向判断,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力。
【简答题】

[9/726](11分)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH 4+、K +、Al 3+、HCO 3—、Cl —、MnO 4—、SO 42-...
参考答案:
|
(1)
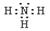 (2)MnO
4
-、HCO
3
-、Cl
-; NH
4
+、Al
3+、SO
4
2- (2)MnO
4
-、HCO
3
-、Cl
-; NH
4
+、Al
3+、SO
4
2-
(3)2MnO 4 -+5SO 2+2H 2O=2Mn 2++5SO 4 2-+4H + (4)焰色反应,用洁净的铂丝蘸取试样在无色火焰上灼烧, 透过蓝色钴玻璃,观察火焰颜色,若紫色,则含有K +。 (5)0.1 |
参考解析:
无色溶液,则MnO 4 -一定不存在,根据①溶液呈酸性,则HCO 3 -一定不存在,根据②可知溶液中一定有SO 4 2-,且SO 4 2-为0.03mol,一定没有Cl -,根据④可以确定溶液中一定有NH 4 +和Al 3+。
据图可知加入Na 2O 20.15mol,沉淀达到最大值,则Al 3+为0.1mol,Na 2O 2从0.15mol增至0.25mol是与NH 4 +反应产生氨气,则NH 4 +为0.2mol,根据溶液中电荷守恒,一定有K +且为0.1mol。
点评:本题综合性强,主要锻炼学生的推断能力,难度较大,尤其最后的计算。
【简答题】

[10/726]目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。 (1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池...
参考答案:
|
(1)Zn(1分); (2)①Cl 2+2OH —=Cl —+ClO —+H 2O(2分)②<(2分); (3)杀菌消毒(1分),净化(1分); (4)①先变大,后变小(2分)②HFeO 4 -转化为FeO 4 2—(2分)。 |
参考解析:
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,根据电池的形成条件,其中高铁酸钾为正极材料得电子;负极失电子的是锌,故电池负极材料是Zn;
(2)①分析反应①是将氯气通入到氢氧化钠溶液中,其离子方程式为:Cl 2+2OH —=Cl —+ClO —+H 2O;②反应③是:Na 2FeO 4 + 2KOH=K 2FeO 4 + 2NaOH,其能在某低温下进行的,说明此温度下K sp(K 2FeO 4)<K sp(Na 2FeO 4);
(3)由于K 2FeO 4在水溶液中可以发生:4FeO 4 2—+10H 2O
 4Fe(OH)
3↓+8OH
—+3O
2↑,故K
2FeO
4在水处理中起到了杀菌消毒的作用;生成的胶状氢氧化铁还有净化作用;
4Fe(OH)
3↓+8OH
—+3O
2↑,故K
2FeO
4在水处理中起到了杀菌消毒的作用;生成的胶状氢氧化铁还有净化作用;
(4)①分析FeO 4 2—在水溶液中的存在形态图,可知在pH由10变化到2时,HFeO 4 -的分布分数是先变大,后变小;②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中HFeO 4 -转化为FeO 4 2—。

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫